Zadanie 1.
ZADANIE 1:
Optymalizacja procedury testowania molekularnego, opartego na technologii Real-Time PCR i powiązanie testów molekularnych z testami serologicznymi i immunologicznymi ze szczególnym uwzględnieniem sytuacji wykrywania w badaniach molekularnych wyłącznie fragmentów wirusa oraz jego wariantów.
W ramach procedury opracowano badanie charakterystyki ewolucji przeciwciał anty-SARS CoV-2 IgG i IgM u pacjentów hospitalizowanych w kolejnych punktach czasowych i powiązanie ich z obecnością materiału genetycznego wirusa oraz częstością zgonów u pacjentów hospitalizowanych. Optymalizowano
testowanie molekularne, opartego na technologii Real-Time PCR i powiązano wyniki testów molekularnych z testami serologicznymi i immunologicznymi przeprowadzono badania serologiczne wykrywające przeciwciała anty-SARS CoV-2 w klasie IgG i IgM – skierowane na podjednostkę S1 tego wirusa w momencie diagnozy oraz co 7 dni jeśli pacjent przebywał w szpitalu i skorelowano ich charakterystykę z obecnością materiału genetycznego wykrywanego w technologii Real-Time PCR. Ponieważ czas hospitalizacji pacjentów różnił się istotnie pierwszoplanowo oceniano obecność przeciwciał IgG i IGM i ich korelację z obecnością materiału genetycznego SARS CoV-2 w punkcie czasowym „0” a więc przy przyjęciu do szpitala. W tym punkcie czasowym wykonano 2855 oznaczeń (1601, 56,07% u mężczyzn oraz 1254 (43,92%) u kobiet).
Obserwowano, że 35,17% pacjentów w punkcie „0” posiadało przeciwciała IgG, a 35,60% IgM. Materiał genetyczny SARS CoV-2 wykonywane w technologii Real-Time PCR wykryto u 2271 osób (92,77%), u osób z przeciwciałami IgG materiał genetyczny SARS CoV-2 wykryto istotnie rzadziej (88,19%) w porównaniu do osób bez takich przeciwciał (95,12%), p<0.001. Dla przeciwciał IgM zależność była odwrotna – materiał genetyczny SARS CoV-2 był obecny w 95,25% prób z tymi przeciwciałami i 88.14 bez nich, p <0.001. W ramach analiz wariantów i związku pomiędzy wykrywaniem fragmentów genetycznych wirusa a obecnością przeciwciał wykryto mutację E484K/E484Q, L452R, oraz N501Y odpowiednio u 44,04%, 44.24% i 44,0% osób z IgG i 16,1%, 16,3% oraz 16.24% osób z IgM.
W analizach związku pomiędzy obecnością przeciwciał ocenianych w punkcie ‘0’ a ciężkością przebiegu choroby określoną jako ryzyko zgonu określono istotny związek pomiędzy brakiem obecności IgG u osób hospitalizowanym a zgonem (odpowiednio 19.87% zgonów u osób bez IgG i 13.84% u osób bez tych przeciwciał, P<0.001, podobną asocjację obserwowano dla ryzyka wentylacji mechanicznej która była konieczna u 4.58% osób z IgG i 7.07% bez tych przeciwciał. Nie obserwowano związku pomiędzy obecnością IgM w pkt „0” a ryzykiem wentylacji mechanicznej podczas gdy asocjacja z obecnością IgM w kontekście ryzyka zgonu była odwrotna (zgon odnotowano u 19.31% osób z IgM vs. 14.95% bez tych przeciwciał, p=0.008).
W kolejnych punktach czasowych pobrano przeciwciała u 373 osób po 7 dniach od przyjęcia do szpitala, obserwując seroprewalencję na poziomie 81.76% dla IgM i 87.6% dla IgG, w punkcie czasowym 14 dni od przyjęcia badania pobrano od 199 osób z seroprewalencją 87% dla IgM i 96.6% dla IgG. W punkcie czasowym 28 dni przeciwciała IgM były obecne u 72.7% pacjentów a IgG u 100% (n=32). Zmniejszające się grupy do oceny wynikały zarówno z progresji zakażenia i wymierania części populacji, dlatego odstąpiono od dalszych analiz asocjacji.
W ramach dalszych analiz w zakresie immunofenotypowania i analiz czynników ryzyka powikłań zatorowo-zakrzepowych, dlatego odstąpiono od podsumowania tych wyników jako procedury medycznej. W ramach tego zadania opracowano jednakże procedurę oznaczania immunofenotypu PD-1 związanego z wycieńczeniem immunologicznym osób przyjmowanych do szpitala i związkiem tego immunofentoypu ze zgonem i ryzykiem ciężkiego przebiegu. Porównano immunofenotypy krwi hospitalizowanych pacjentów z umiarkowanym i ciężkim COVID-19 (wymagającym wentylacji mechanicznej na oddziale intensywnej terapii) i powiązano je z danymi klinicznymi, laboratoryjnymi i przeżyciem. Powiązania między nasileniem choroby a profilami limfocytów analizowano na początku badania oraz po 7 i 14 dniach leczenia szpitalnego. Dla limfocytów T i B PD-1-dodatnich zaobserwowano znaczny wzrost ekspresji między grupą kontrolną a pacjentami z umiarkowanym lub ciężkim COVID-19 (w szczególności dla CD4+PD-1+, T CD8+PD-1+ i CD19+PD-1 + dla limfocytów B). Wszystkie markery związane z PD-1 i PD-L1 były stabilne w czasie dla analizowanych punktów czasowych w grupach z umiarkowanym i ciężkim COVID-19. Zwiększona liczebność limfocytów PD-1+ i PD-L1+ była związana z ciężkością choroby i śmiertelnością. Zidentyfikowano powyższe parametry wyczerpania immunologicznego jako biomarkery nasilenia COVID-19 (Rycina 1). Wdrożono do rutynowej kontroli diagnostycznej pacjentów przyjętych do szpitala z COVID-19 parametrów immunologicznych opartych o ocenę ekspresji czynnika PD-1 i PD-L1 jako biomarkerów świadczących o wycieńczeniu immunologicznym jako determinanty prognostycznej. Wycieńczenie immunologicznej rejestrowane jest bowiem częściej u pacjentów z ciężkim przebiegiem COVID-19 i bezpośrednio przekłada się na wyższą śmiertelność pacjentów. Badania wykonywane są z wykorzystaniem cytometrii przepływowej w barwieniu dwukolorowym, tj. z przeciwciałem dedykowanym subpopulacji CD4, CD8 oraz PD-1/PD-L1. Analizy dały podstawę do dalszych opracowań dotyczących przeżycia i burzy cytokinowej.
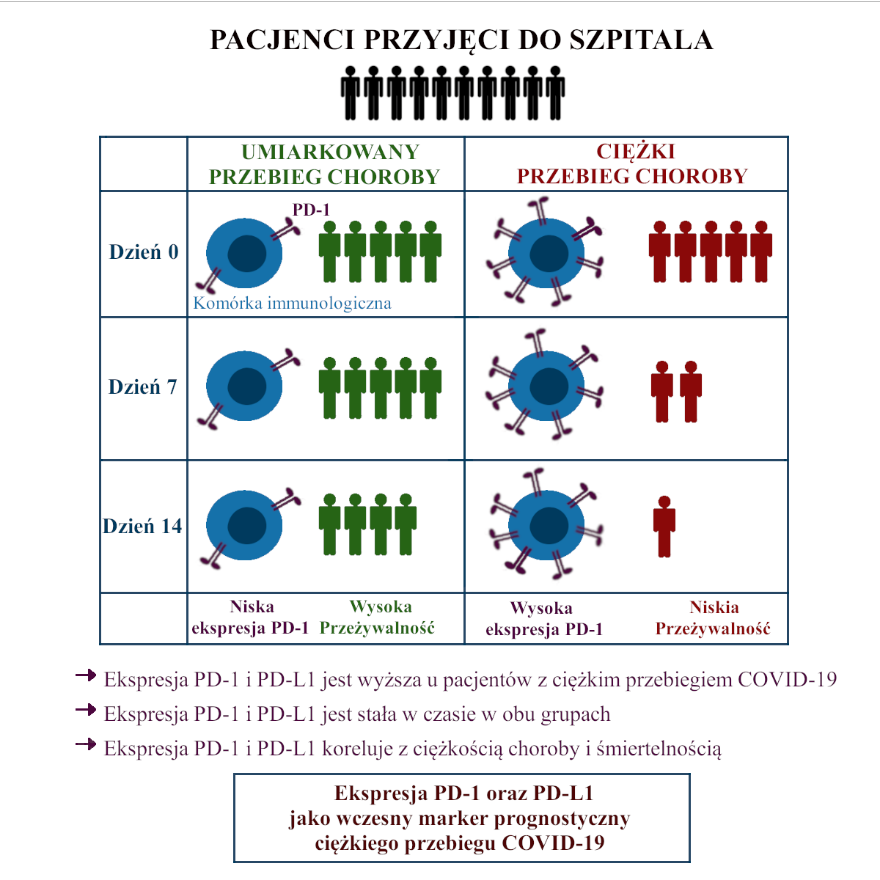
Rycina 1. Badanie ekspresji PD-1 jako czynnika ryzyka ciężkiego przebiegu zakażenia SARS CoV-2.
Podstawę opracowań w zakresie burzy cytokinowej opublikowano w pracy:
Niedźwiedzka-Rystwej P, Majchrzak A, Kurkowska S, Małkowska P, Sierawska O, Hrynkiewicz R, Parczewski M. Immune Signature of COVID-19: In-Depth Reasons and Consequences of the Cytokine Storm. Int J Mol Sci. 2022 Apr 20;23(9):4545. doi: 10.3390/ijms23094545. PMID: 35562935; PMCID: PMC9105989.
https://www.mdpi.com/1422-0067/23/9/4545
Wyniki zadania w takcie recenzji w pracy:
“Programmed cell death-1/programmed cell death-1 ligand as prognostic markers of coronavirus disease-2019 severity”.




